
因为疫情原因,2020年5月 23—24日召开的ESMO BC会议改为在线虚拟会议。在本次大会上,有多项临床研究结果报道,包括很多来自真实世界的研究,为指导临床实践具有重要参考价值。其中,两项分别来自美国和德国的真实世界研究分析了CDK4/6抑制剂哌柏西利联合内分泌治疗的疗效和安全性,结果显示靶向CDK4/6i时代,真实世界中CDK4/6抑制剂哌柏西利联合方案能够给患者带来更好的疗效,包括提高ORR、PFS率和OS率,同时多数患者无需调整剂量,安全性与生活质量令人满意。
OS显著优势,ORR 59.8%——美国Flatiron真实世界最佳疗效分析
在1383例可评估患者中,一线治疗时,哌柏西利联合来曲唑组和来曲唑组分别有662例和306例患者进行过≥1 次肿瘤疗效评估。
在调整社会人口学和临床特征后,多因素分析显示,哌柏西利+来曲唑组与安慰剂+来曲唑组的中位rwPFS为27.4个月和15.4个月(HR = 0.60;95%CI 0.46 ~ 0.79;P = 0.0002)。两组的中位OS均未达到(HR = 0.58;95%CI 0.39 ~ 0.85;P = 0.0052),但已经显示出显著差异,疾病死亡风险降低42%。
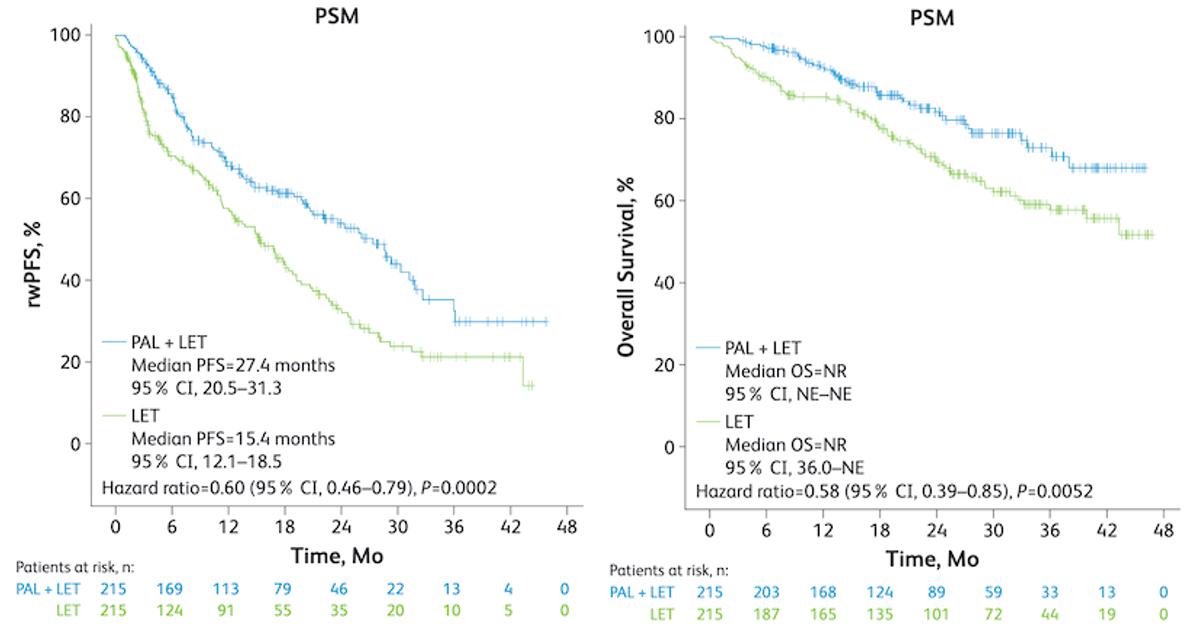
图1. rwPFS和rwOS分析
真实世界最佳肿瘤反应分析结果显示,在调整社会人口学和临床特征后,多因素分析显示,哌柏西利联合来曲唑组对比来曲唑组取得客观缓解的几率增加2倍(58.6% vs 29.1%;OR = 2.2;95%CI 1.5 ~ 3.2;P < 0.0001)。
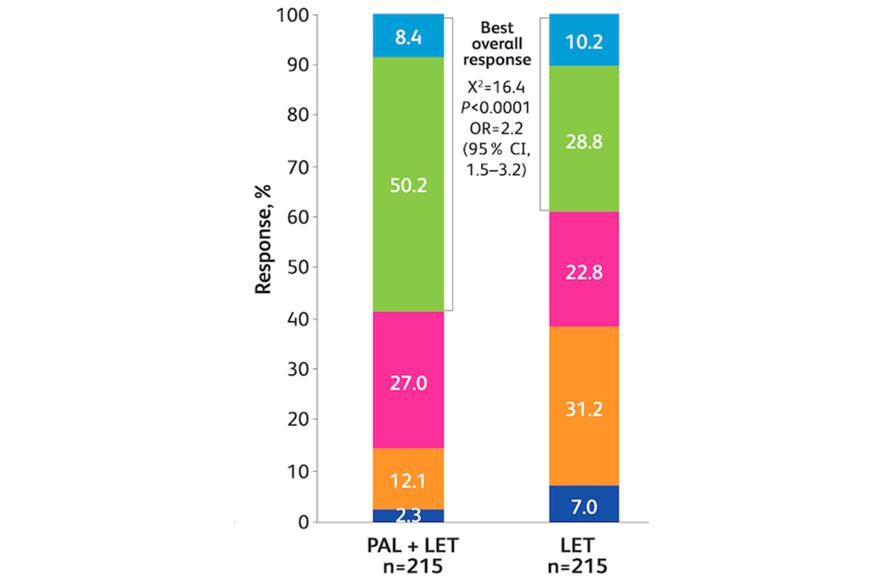
图2. 真实世界最佳肿瘤反应
本次ESMO BC报道的这项来自美国的真实世界研究比较了哌柏西利联合来曲唑对比来曲唑用于转移性乳腺癌一线治疗的最佳疗效。在这项回顾性分析中,研究者对Flatiron健康数据库的患者进行分析,这一数据库纳入了美国280个癌症诊所,超过220万癌症患者。2015年2月—2018年9月,共1383例HR+/HER2–哌柏西利联合来曲唑(n = 754)或来曲唑 (n = 629) 一线治疗。自患者开始服药时进行随访,直至整个治疗过程结束或患者死亡,两组中位随访时间分别为20.6个月和22.3个月。真实世界最佳疗效定义为临床医生根据影像学资料进行评估,在整个治疗过程中的最佳疗效。
这一研究提示,HR+/HER2-的转移性乳腺癌接受哌柏西利联合来曲唑对比来曲唑治疗,更有可能取得客观缓解。鉴于在真实世界临床实践中,患者可能不按照规定的时间进行随访,因此,推荐HR+/HER2- 的转移性乳腺癌接受哌柏西利联合来曲唑作为标准治疗。
53.6%的患者达到CR,98.7%的患者维持125mg剂量无需调整——来自IRIS研究德国真实世界数据
本次报告的IRIS德国数据自接受哌柏西利开始计算,P+AI和P+F治疗组患者的中位随访时间分别为8.2个月和5.3个月。哌柏西利+AI(P+AI)组与哌柏西利+氟维司群(P+F)组分别有53.6%和38%的患者达到了CR,分别有30.5%和44.6%的患者达到PR。即P+AI组患者达到CR+PR的占比达到84.1%,而P+F组的患者则达到82.6%。

图3. 最佳反应分析
24个月时P+AI组的PFS率和OS率均分别为84.9%和92.2%;P+F组的PFS率和OS率分别为72.3%和85.8%。
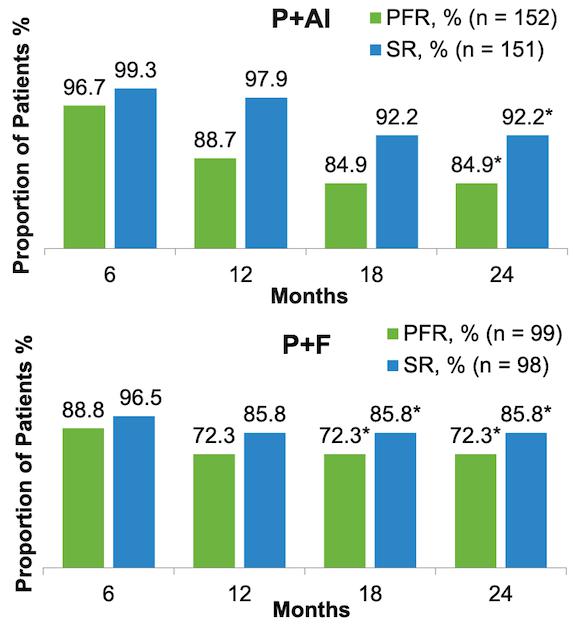
图4. 至事件发生时间
几乎所有的患者, 哌柏西利的起始剂量都是125 mg/天(P+AI组98.7%,P+F组96.0%)。在这些患者中,P+AI和P+F组分别有14.0%和11.6%的患者进行剂量调整。
图5. 真实世界中哌柏西利用药剂量与剂量调整分析
作为第一个在德国获批的CDK4/6抑制剂,哌柏西利已经获批联合芳香化酶抑制剂(P+AI)或氟维司群(P+F)用于HR+/HER2- 晚期乳腺癌。本研究报道了哌柏西利多个国家真实世界研究IRIS的部分研究结果,分析患者的临床治疗模式和治疗结局。本次回顾性分析,纳入德国2019年7月至10月期间接受哌柏西利联合治疗的HR+/HER2-晚期乳腺癌,分析患者的特征、治疗模式和治疗结局。采用Kaplan-Meier法分析6、12、18、24个月时的无进展生存(PFS)率和总生存(OS)率。同时,研究还对患者治疗的疗效进行评估,确认患者疗效是CR/PR/SD/PD,并对患者在治疗过程中的剂量调整比例进行分析。
共35个肿瘤内科医生完成了251例患者电子病历录入。总体而言,152例患者接受P+AI 治疗,99例患者接受P+F治疗。患者开始P+AI和P+F治疗时的平均年龄分别为54.9岁(SD:9.0) 和56.3岁(SD:7.9)。50% ~ 60%的患者开始治疗时,ECOG PS评分为0分 (P+AI组为57.2%;P+F组为46.5%)或1分 (P+AI组为22.4%;P+F组为28.3%)。P+AI组和P+F组分别有5.2%和4.0%的患者开始治疗时ECOG PS评分≥2分;15.1%和21.2%的患者ECOG PS状态未知。在合并转移的患者中,(P+AI组n = 123,P+F组n = 77), P+AI 组和P+F组分别有51.2%和58.4%的患者合并内脏转移;26.0%和24.7%的患者仅骨转移。在本次数据收集时,大多数的患者(P+AI 组为73.7%;P+F组为83.8%)仍在接受治疗。
在这一真实世界研究中,哌柏西利联合治疗时,进行剂量调整的患者比例较低。目前这一研究的随访时间虽然较短,但观察到哌柏西利联合治疗的PFS率和OS率仍较高,显示出联合方案的有效性。
作为第一个在德国获批的CDK4/6抑制剂,哌柏西利已经获批联合芳香化酶抑制剂(P+AI)或氟维司群(P+F)用于HR+/HER2- 晚期乳腺癌。本研究报道了哌柏西利多个国家真实世界研究IRIS的部分研究结果,分析患者的临床治疗模式和治疗结局。这是一项回顾性分析,纳入德国2019年7月至10月期间接受哌柏西利联合治疗的HR+/HER2-晚期乳腺癌,分析患者的特征、治疗模式和治疗结局。采用Kaplan-Meier法分析24个月时的无进展生存(PFS)率和总生存(OS)率。
在这一真实世界研究中,哌柏西利联合治疗时,进行剂量调整的患者比例较低。目前这一研究的随访时间虽然较短,但观察到哌柏西利联合治疗的PFS率和OS率仍较高,显示出联合方案的有效性。
总结
哌柏西利作为第一个上市的CDK4/6抑制剂,目前已经积累了一定的真实世界临床使用经验。在本次报道的FLATRION数据库真实世界数据中,CDK4/6抑制剂联合AI能够给患者带来显著的OS获益,ORR较对照组翻倍;而IRIS德国数据分析中则显示选择哌柏西利联合AI或氟维司群,均能获得非常高的CR率,而治疗过程中几乎所有患者初始治疗剂量均为125 mg,仅少数患者出现剂量调整,安全性与生活质量有非常好的保障。上述研究结果证实,哌柏西利真实世界应用可以取得和临床研究相当的结果,能够降低患者疾病复发或死亡风险,且安全性良好,是HR+/HER2-晚期乳腺癌患者不可或缺的治疗选择。
参考文献
[1].Brufsky A, Liu XC, Li B, et al. Real-world tumour response of palbociclib plus letrozole vs letrozole for metastatic breast cancer in US clinical practices.2020 ESMO BC. ABR 176P.
[2].Mycock KL, Taylor- Stokes G, Zhan L, et al. Real world treatment patterns and clinical outcomes associated with palbociclib combination therapy in Germany: Results from the IRIS study. 2020 ESMO BC. ABR 177P.
